Gas

| Part of a series on |
| Continuum mechanics |
|---|
기체(gas)는 물질의 네 가지 기본 상태 중 하나입니다. 다른 것은 고체(solid), 액체(liquid), 및 플라즈마(plasma)입니다.[1]
순수한 기체는 (예를 들어, 네온(neon)과 같은 귀족 기체(noble gas)) 개별 원자들, (예를 들어, 산소(oxygen)) 원자의 한 형태로 만들어진 원소(elemental) 분자, 또는 (예를 들어, 이산화탄소(carbon dioxide)) 원자들의 모은 것으로 만들어진 화합물(compound) 분자로 만들 수 있습니다. 공기(air)와 기체 혼합물(mixture)은 다양한 순수 기체를 포함합니다. 액체와 고체로부터 기체의 구별은 개별 기체 입자(particles)의 방대한 분리입니다. 이 분리는 인간 관찰자에게 보이지 않는 무색의 기체를 보통 만듭니다.
물질의 기체 상태는 액체 상태와 플라즈마 상태 사이에서 발견되며,[2] 그것의 후자는 기체에 대한 위쪽 온도 경계를 제공합니다. 온도 스케일의 아래쪽 끝은, 점점 더 주목을 받고 있는,[3] 퇴행성 양자 기체들이 위치합니다.[4]
Elemental gases
STP에서 안정한 이원자 동핵 분자 기체인 유일한 화학적 원소는 수소 (H2), 질소 (N2), 산소 (O2), 및 2개의 할로겐: 불소 (F2)와 염소 (Cl2)입니다. 헬륨 (He), 네온 (Ne), 아르곤 (Ar), 크립톤 (Kr), 크세논 (Xe), 및 라돈 (Rn)과 같은 단원자 귀족 기체와 함께 그룹화될 때, 이들 기체는 "원소 기체"라고 참조됩니다.
Etymology
단어 gas는 17세기 초 플랑드르 화학자 얀 밥티스타 판 헬몬트(Jan Baptist van Helmont)에 의해 처음 사용되었습니다.[5] 그는 공기 이외의 최초의 알려진 기체, 이산화탄소(carbon dioxide)를 식별했습니다.[6] 판 헬몬트의 단어는 단순히 고대 그리스어 χάος Chaos – 네덜란드어에서 g는 "loch"에서 ch (무성 연구개 마찰음, /x/)처럼 발음됨 – 의 음성 표기인 것으로 보이며, 이 경우에서 판 헬몬트는 단순히 파라켈수스(Paracelsus)의 연구에서 처음 입증된 확립된 연금술적 사용을 단순히 따르고 있었습니다. 파라켈수스의 용어에 따르면, chaos은 "초-희박 물"과 같은 것을 의미했습니다.[7]
또 다른 이야기는 판 헬몬트의 용어가 "유령 또는 영혼을 의미하는 gahst (또는 geist)"에서 파생되었다는 것입니다.[8] 그 이야기는 옥스퍼드 영어사전의 편집자들에 의해 신뢰되지 않습니다.[9] 대조적으로, 프랑스계 미국인 역사가 Jacques Barzun은 판 헬몬트가 발효(fermentation)에서 생기는 거품을 의미하는 독일어 Gäscht에서 단어를 차용했다고 추측했습니다.[10]
Physical characteristics
대부분의 기체는 직접 관찰하기 어렵기 때문에, 그것들은 압력, 부피, 입자의 개수 (화학자는 그것들을 몰에 의해 그룹화), 및 온도와 같은 네 가지 물리적 속성 또는 거시적 특성을 사용하여 설명됩니다. 이들 네 가지 특성은 다양한 환경에서 다양한 기체에 대해 Robert Boyle, Jacques Charles, John Dalton, Joseph Gay-Lussac, 및 Amedeo Avogadro와 같은 과학자들에 의해 반복적으로 관찰되었습니다. 그것들의 상세한 연구는 궁극적으로 이상적인 기체 법칙에 의해 표현되는 이들 속성 사이의 수학적 관계로 이어졌습니다 (아래 단순화된 모델 섹션을 참조).
기체 입자는 서로 넓게 분리되어 있고, 결과적으로, 액체나 고체보다 약한 분자-사이 결합을 가집니다. 이들 분자-사이 힘(intermolecular forces)은 기체 입자 사이의 정전기적 상호 작용에서 비롯됩니다. 서로 다른 기체 입자의 같은-전하 영역은 반발하는 반면, 서로 다른 기체 입자의 반대 전하 영역은 서로 끌어당깁니다; 영구적으로 하전된 이온(ions)을 포함하는 기체는 플라즈마(plasmas)로 알려져 있습니다. 극성 공유(polar covalent) 결합을 갖는 가스체의 화합물은 영구적인 전하 불균형을 포함하고 따라서 화합물의 알짜 전하가 중성을 유지하는 동안 분자는 상대적으로 강한 분자-사이 힘을 경험합니다. 과도하고, 무작위로 유도된 전하는 분자의 비-극성 공유 결합(covalent bonds)에 걸쳐 존재하고 이로 인해 발생하는 정전기적 상호 작용을 반 데르 발스 힘(Van der Waals forces)이라고 참조됩니다. 이들 분자-사이 힘의 상호 작용은 각 기체에 고유한 많은 물리적 속성을 결정하는 물질 내에서 다양합니다.[11][12] 이온 결합과 공유 결합에 의해 형성된 화합물에 대한 끓는 점의 비교는 이러한 결론으로 이어집니다.[13] 이미지에서 표류하는 연기 입자는 낮은-압력 기체 동작에 대한 통찰력을 제공합니다.
다른 물질 상태에 비해, 기체는 낮은 밀도와 점도를 가집니다. 압력과 온도는 특정 부피 내의 입자에 영향을 미칩니다. 입자 분리와 속력에서 이러한 변화는 압축가능성이라고 참조됩니다. 이 입자 분리와 크기는 다음 굴절 인덱스의 목록에서 볼 수 있는 것처럼 기체의 광학적 속성에 영향을 미칩니다. 마지막으로, 기체 입자는 용기 전체에 균등하게 분산되기 위해 분산되거나 확산됩니다.
Macroscopic view of gases

기체를 관찰할 때, 참조 프레임 또는 길이 스케일(length scale)을 지정하는 것이 전형적입니다. 더 큰 길이 스케일은 기체의 거시적 또는 전체적인 관점에 해당합니다. 이 영역 (부피라고 참조됨)은 기체 입자의 많은 표본화를 포함하기에 충분한 크기여야 합니다. 이 표본 크기에 대한 결과 통계적 분석은 그 지역 내 모든 기체 입자의 "평균" 동작 (즉, 속도, 온도, 또는 압력)을 생성합니다. 대조적으로, 더 작은 길이 스케일은 미시적 또는 입자적 관점에 해당합니다.
거시적으로, 측정된 기체 특성은 기체 입자 자체 (속도, 압력, 또는 온도) 또는 주변 환경 (부피) 측면에서 측정됩니다. 예를 들어, 로버트 보일은 경력의 일부 동안 공압 화학(pneumatic chemistry)을 공부했습니다. 그의 실험 중 하나는 기체의 압력과 부피의 거시적 특성과 관련이 있습니다. 그의 실험은 J자 모양의 시험관처럼 보이는 J-튜브 기압계(manometer)를 사용했습니다. 보일은 수은(mercury) 기둥을 갖는 시험관의 닫힌 끝에 불활성(inert) 기체를 가두어, 입자의 수와 온도를 일정하게 만들었습니다. 그는 기둥에 더 많은 수은을 추가하여 가스의 압력이 증가하면 갇힌 기체의 부피가 감소한다는 것을 관찰했습니다 (이는 역(inverse) 관계로 알려져 있습니다). 게다가, 보일이 각 관측의 압력과 부피를 곱했을 때, 그 곱은 일정했습니다. 이 관계는 보일이 이 분야에서 그의 업적을 기리기 위해 이름-지은 법칙 (PV=k)으로 이어지는 것을 관찰한 모든 기체에 대해 유지되었습니다.
기체 속성을 분석하는 데 사용할 수 있는 많은 수학적 도구가 있습니다. 기체가 극한 조건에 노출됨에 따라 이들 도구는 비-점성 흐름에 대한 오일러 방정식(Euler equations)에서 점성 효과를 완전히 설명하는 나비에-스토크스 방정식(Navier–Stokes equations)에 이르기까지 더욱 복잡해집니다.[14] 이들 방정식은 해당 기체 시스템의 조건에 맞게 조정됩니다. 보일의 실험실 장비는 분석 결과를 얻기 위해 대수학(algebra)을 사용할 수 있게 해주었습니다. 그의 결과는 그가 "이상적인" 방식으로 거동하는 상대적으로 낮은 압력 상황에서 기체를 연구했기 때문에 가능했습니다. 이들 이상적인 관계는 사용 중인 재료에 대한 다양한 비행 조건에 대한 안전 계산에 적용됩니다. 오늘날 사용되는 첨단 장비는 기체가 더 이상 "이상적인" 방식으로 작용하지 않는 보다 이국적인 작동 환경을 안전하게 탐색할 수 있도록 설계되었습니다. 통계와 다변수 미적분을 포함한 이 고급 수학은 우주선 재진입과 같은 복잡한 동적 상황에 대한 해를 가능하게 합니다. 예를 들어 이 적재 조건에서 재료 특성이 적절한지 확인하기 위해 그려진 우주 왕복선 재진입 분석이 있습니다. 이 비행 체제에서, 기체는 더 이상 이상적으로 작동하지 않습니다.
Pressure
방정식에서 압력을 나타내기 위해 사용되는 기호는 파스칼(pascals)의 SI 단위를 갖는 "p" 또는 "P"입니다.
기체의 용기를 설명할 때, 압력 (또는 절대 압력)이라는 용어는 기체가 용기 표면에 가하는 단위 넓이당 평균 힘을 참조합니다. 이 부피 내에서, 기체 입자가 용기와 충돌할 때까지 직선으로 움직이는 것을 시각화하는 것이 때때로 더 쉽습니다 (기사 상단의 다이어그램을 참조). 이 충돌 동안 기체 입자가 용기에 가하는 힘은 입자의 운동량(momentum)에서 변화입니다.[15] 충돌하는 동안, 속도의 법선(normal) 성분만 변경됩니다. 벽에 평행하게 이동하는 입자는 운동량을 변경하지 않습니다. 따라서, 표면에 가해지는 평균 힘은 이들 모든 기체 입자 충돌로 인한 선형 운동량(linear momentum)에서 평균 변화여야 합니다.
압력은 용기의 벽에 충돌하는 입자가 가하는 힘의 모든 법선 성분(normal components)을 벽의 표면 넓이로 나눈 값의 합입니다.
Temperature
방정식에서 온도를 나타내기 위해 사용되는 기호는 켈빈(kelvins)의 SI 단위를 갖는 T입니다.
기체 입자의 속력은 그것의 절대 온도(absolute temperature)에 비례합니다. 영상 속 풍선의 부피는 갇힌 기체 입자가 극단적으로 차가운 질소를 첨가하여 느려질 때 줄어듭니다. 임의의 물리적 시스템(physical system)의 온도는 [기체] 시스템을 구성하는 입자 (분자와 원자)의 움직임과 관련이 있습니다.[16] 통계적 역학(statistical mechanics)에서, 온도는 분자에 저장된 평균 운동 에너지 (열 에너지라고도 함)의 측정입니다. 이 에너지를 저장하는 방법은 분자 자체의 자유도 (에너지 모드)에 따라 결정됩니다. 기체 또는 액체 (흡열 과정)에 추가된 열 (운동) 에너지는 평행이동, 회전, 및 진동 운동을 생성합니다. 대조적으로, 결정 격자 구조가 평행이동 운동과 회전 운동을 모두 방지하기 때문에, 고체는 추가 진동 모드를 자극함으로써 오직 내부 에너지를 증가시킬 수 있습니다. 이들 가열된 기체 분자는 더 높은 평균 속력을 갖는 더 큰 속력 범위 (더 넓은 속력의 분포)를 가집니다. 이 분포의 분산은 다른 입자와의 반복적인 충돌로 인해 개별 입자의 속력이 지속적으로 변하기 때문입니다. 속력 범위는 맥스웰-볼츠만 분포(Maxwell–Boltzmann distribution)에 의해 설명될 수 있습니다. 이 분포의 사용은 고려 중인 입자의 시스템에 대한 열역학적 평형(thermodynamic equilibrium)에 가까운 이상적인 기체(ideal gases)를 의미합니다.
Specific volume
방정식에서 특정 부피를 나타내기 위해 사용되는 기호는 SI 킬로그램당 세제곱 미터의 SI 단위를 갖는 "v"입니다.
방정식에서 부피를 나타내기 위해 사용되는 기호는 세제곱 미터의 SI 단위를 갖는 "V"입니다.
열역학(thermodynamic) 분석을 수행할 때, 집약적이고 광범위한 속성을 말하는 것이 전형적입니다. 기체의 양 (질량 또는 부피)에 따라 달라지는 속성은 확장(extensive) 속성이라고 불리고, 반면에 기체의 양에 따라 달라지지 않는 속성은 집중( intensive) 속성이라고 합니다. 특정 부피는 평형 상태에서 시스템 전체에서 동일한 기체의 단위 질량이 차지하는 부피의 비율이기 때문에 집중 속성의 예제입니다.[17] 1000개의 원자와 기체는 임의의 주어진 온도와 압력에 대해 임의의 다른 1000개의 원자와 같은 공간을 차지합니다. 이 개념은 기체에 비해 비-압축가능(incompressible)인 철과 같은 고체에 대해 시각화하기가 더 쉽습니다. 어쨌든, 부피 자체는 --- 구체적이지 않고 --- 광범위한 속성입니다.
Density
방정식에서 밀도를 나타내기 위해 사용되는 기호는 세제곱 미터당 킬로그램의 SI 단위를 갖는 ρ (rho)입니다. 이 용어는 특정 부피의 역수(reciprocal)입니다.
기체 분자는 용기 내에서 자유롭게 움직일 수 있기 때문에, 그것들의 질량은 통상적으로 밀도에 의해 특징짓습니다. 밀도는 물질의 단위 부피당 질량의 총양 또는 특정 부피의 역수입니다. 기체에 대해, 입자가 압력이나 부피의 제약을 받을 때 자유롭게 서로 더 가까이 이동할 수 있기 때문에 밀도는 넓은 범위에서 달라질 수 있습니다. 이러한 밀도의 변화는 압축가능성(compressibility)이라고 참조됩니다. 압력과 온도와 마찬가지로, 밀도는 기체의 상태 변수(state variable)이고 임의의 과정 중 밀도의 변화는 열역학 법칙에 의해 제어됩니다. 정적 기체(static gas)에 대해, 밀도는 용기 전체에 걸쳐 같습니다. 따라서 밀도는 스칼라 양(scalar quantity)입니다. 일정량의 기체가 담겨 있는 용기의 크기에 밀도가 반비례한다는 것을 운동학 이론으로 나타낼 수 있습니다. 이 고정 질량의 경우에서, 부피가 증가함에 따라 밀도가 감소합니다.
Microscopic view of gases
만약 강력한 현미경으로 기체를 관찰할 수 있다면, 어떤 명확한 모양이나 부피 없이 다소 무작위로 움직이는 입자들의 집합체를 볼 수 있을 것입니다. 이들 기체 입자는 또 다른 입자나 용기 측면과 충돌할 때만 방향을 바꿉니다. 기체에 대한 이러한 미시적 관점은 통계적 역학에 의해 잘 설명되지만, 많은 다른 이론으로 설명될 수 있습니다. 이들 충돌이 완전한 탄성이라는 가정을 하는 기체의 운동 이론은 분자-사이 인력과 반발력을 설명하지 않습니다.
Kinetic theory of gases
운동 이론(Kinetic theory)은 분자 구성과 움직임을 고려함으로써 기체의 거시적 속성에 대한 통찰력을 제공합니다. 운동량(momentum)과 운동 에너지(kinetic energy)의 정의부터 시작하여,[18] 운동량 보존(conservation of momentum)과 정육면체의 기하학적 관계를 사용하여 온도와 압력의 거시적 시스템 속성을 분자당 운동 에너지의 미시적 속성과 연관시킬 수 있습니다. 이론은 이들 두 속성에 대한 평균화된 값을 제공합니다.
기체의 운동 이론은 시스템 (고려되는 기체 입자의 집합의 모음)이 운동 에너지의 상응하는 변화와 함께 온도 변화에 어떻게 반응하는지 설명하는 데 도움이 될 수 있습니다.
예를 들어: 고정된 수의 기체 입자를 포함하는 고정된-크기 (일정한 부피)의 밀폐된 용기가 있다고 상상해 보십시오; 절대 영도 (원자 또는 분자가 열 에너지를 가지지 않는, 즉, 움직이거나 진동하지 않는 이론적인 온도)에서 시작하여, 용기를 가열함으로써 에너지가 입자 내부로 전달되도록 시스템에 에너지를 추가하기 시작합니다. 일단 그것들의 내부 에너지(internal energy)가 영-점 에너지보다 위에 있으면, 즉 그것들의 운동 에너지 (열 에너지라고도 함)가 비-영이면, 기체 입자가 용기 주위를 움직이기 시작할 것입니다. 상자가 더 가열됨에 따라 (더 많은 에너지가 추가됨에 따라), 개별 입자는 시스템의 총 내부 에너지가 증가함에 따라 평균 속력이 증가합니다. 모든 입자의 더 높은 평균 속력은 입자와 용기 사이와 마찬가지로 입자 자체 사이에서 충돌이 발생하는 더 높은 율 (즉, 단위 시간당 더 많은 충돌 횟수)로 이어집니다.
거시적이고, 측정-가능한 양의 압력은 이들 미시적 입자가 표면과 충돌한 직접적인 결과이며, 그 위에, 개별 분자가 작은 힘을 가하고, 각 분자는 특정 영역 내에 가해지는 총 힘에 기여합니다. (위의 "Macroscopic view of gases" 섹션에서 "Pressure"을 읽으십시오.)
마찬가지로, 거시적으로 측정-가능한 온도의 양은 입자가 나타내는 전체 운동량 또는 운동 에너지의 정량화입니다. (위의 "Macroscopic view of gases" 섹션에서 "Temperature"를 읽으십시오.)
Thermal motion and statistical mechanics
기체의 운동 이론에서, 운동 에너지는 시스템 내 입자의 속력 분포에 따라 순전히 선형 평행이동으로 구성된다고 가정됩니다. 어쨌든, 실제 기체와 기타 실제 물질에서, 시스템 (집합적으로 온도를 결정함)의 운동 에너지를 정의하는 운동은 분자의 더 복잡한 구조로 인해 단순한 선형 평행이동(translation)보다 훨씬 더 복잡하며, 점-질량(point-masses)과 유사하게 작동하는 단일 원자와 비교됩니다. 실제 열역학 시스템에서, 양자 현상은 열 운동을 결정하는 데 큰 역할을 합니다. 분자에서 무작위 열 운동 (운동 에너지)은 평행이동, 회전, 및 진동을 포함하여 가능한 운동의 유한 집합의 조합입니다. 이 유한한 범위의 가능한 운동은, 시스템에서 유한한 분자 집합과 함께, 시스템 내에서 유한한 수의 미세-상태(microstates)로 이어집니다; 우리는 모든 미세 상태의 집합을 앙상블(ensemble)이라고 부릅니다. 원자 또는 분자 시스템에 따라, 우리는 상황에 따라 잠재적으로 세 가지 다른 종류의 앙상블: 마이크로카노니컬 앙상블(microcanonical ensemble), 카노니컬 앙상블(canonical ensemble), 또는 그랜드 카노니컬 앙상블(grand canonical ensemble)을 가질 수 있습니다. 앙상블 내에서 미세-상태의 특정 조합은 시스템의 거시-상태 (온도, 압력, 에너지 등)를 진정으로 정의하는 방법입니다. 그러기 위해서는, 우리는 먼저 분할 함수(partition function)를 사용하여 모든 미시-상태를 세어야 합니다. 통계적 역학과 분할 함수의 사용은 시스템의 미시적 상태와 우리가 측정할 수 있는 온도, 압력, 열 용량, 내부 에너지, 엔탈피, 및 엔트로피, 등과 같은 거시적 변수 사이의 연결에 핵심이기 때문에 물리적 화학의 전반에 걸쳐 중요한 도구입니다. (읽기: Partition function Meaning and significance)
분할 함수를 사용하여 분자의 에너지 또는 분자 시스템을 찾는 것은 때때로 계산을 크게 단순화하는 등분할 정리(Equipartition theorem)에 의해 근사화될 수 있습니다. 어쨌든, 이 방법은 모든 분자 자유도가 동등하게 채워져 있고, 따라서 분자 내에 에너지를 저장하는 데 동등하게 활용된다고 가정합니다. 이는 내부 에너지가 온도에 따라 선형적으로 변한다는 것을 의미하지만, 그렇지 않습니다. 이것은 낮은 온도에서 특정 자유도에 도달할 수 없기 때문에 (일명 "동결") 온도에 따라 열 용량이 변한다는 사실을 무시합니다. 분자의 내부 에너지가 증가함에 따라, 추가 자유도 내에서 에너지를 저장하는 능력도 증가합니다. 에너지를 보유할 수 있는 자유도가 높아짐에 따라, 이것은 물질의 몰 열 용량이 증가하는 원인이 됩니다.[19]

Brownian motion
브라운 운동은 유체에 부유하는 입자의 무작위 운동을 설명하기 위해 사용되는 수학적 모델입니다. 분홍색과 녹색 입자를 사용하는 기체 입자 애니메이션은 이 행동이 어떻게 기체 확산 (엔트로피)을 초래하는지 보여줍니다. 이들 사건은 입자 이론(particle theory)으로도 설명됩니다.
개별 기체 입자 (원자 또는 분자)를 관찰하는 것은 현재 기술의 한계 (또는 그 이상)에 있기 때문에, 이론적인 계산만이 그것들이 어떻게 움직이는지에 대한 제안을 제공하지만, 브라운 운동은 입자와 개별 (또는 여러) 기체 분자(들)의 격렬한 충돌에 의해 중단되는 많은 기체 분자의 마찰력으로 인한 부드러운 항력을 포함하기 때문에 그것들의 운동은 브라운 운동과 다릅니다. 따라서 입자 (일반적으로 수백만 또는 수십억 개의 원자로 구성됨)는 들쭉날쭉한 경로로 움직이지만, 개별 기체 분자를 검사할 경우 예상되는 것처럼 들쭉날쭉하지 않습니다.
Intermolecular forces - the primary difference between Real and Ideal gases
두 개 이상의 분자 또는 원자 사이의 인력 또는 반발력은 분자-사이 힘(intermolecular forces)이라고 불립니다. 분자-사이 힘은 분자가 서로 물리적으로 근접해 있을 때 발생합니다. 이들 힘은 임의의 시스템에서 분자의 미세한 행동을 정확하게 예측하기 위해 분자 시스템을 적절하게 모델링하는 데 매우 중요하므로, 물리적 조건에서 광범위한 변화에 걸쳐 기체 (및 액체)의 물리적 속성을 정확하게 예측하는 데 필요합니다.
물리적 화학의 연구에서 발생하는, 물리학 전반에 걸쳐 가장 두드러진 분자-사이 힘 중 하나는 반 데르 발스 힘(van der Waals forces)입니다. 반 데르 발스 힘은 점도(viscosity), 흐름 율(flow rate), 및 기체 역학(gas dynamics)과 같은 유체의 거의 모든 물리적 속성을 결정하는 데 중요한 역할을 합니다 (physical characteristics 섹션 참조). 기체 분자 사이의 반 데르 발스 상호작용은 "실제 기체"를 모델링하는 것이 "이상적인 기체"보다 수학적으로 더 어려운 이유입니다. 이들 근접성-의존적 힘을 무시하면 실제 기체를 이상적인 기체처럼 취급하여 계산을 크게 단순화할 수 있습니다.
두 기체 분자 사이의 분자-사이 인력과 반발력은 그들 사이의 거리에 따라 달라집니다. 결합된 인력과 반발력은 분자 시스템의 퍼텐셜 에너지를 설명하는 모든 원자-사이 퍼텐셜 중에서 가장 광범위하게 연구된 것 중 하나인 레너드-존스 퍼텐셜(Lennard–Jones potential)에 의해 잘-모델링됩니다. 분자 사이의 레너드-존스 퍼텐셜은 런던 분산력(London dispersion force)으로 인한 장거리 인력과 전자-전자 교환 상호 작용(exchange interaction)으로 인한 단거리 반발력 (파울리 제외 원리(Pauli exclusion principle)와 관련됨)의 두 가지 개별 구성 요소로 나눌 수 있습니다.
두 분자가 상대적으로 멀리 떨어져 있을 때 (높은 퍼텐셜 에너지를 가짐을 의미), 그것들은 약한 인력을 경험하여, 서로를 향해 이동하여, 퍼텐셜 에너지를 낮춥니다. 어쨌든, 분자가 너무 멀리 떨어져 있으면 그것들은 임의의 중요한 인력을 경험하지 못할 것입니다. 추가적으로, 분자가 너무 가까워지면 그것들은 충돌하고, 인력보다 훨씬 강한 힘인 매우 높은 반발력 (하드 구체로 모델링)을 경험하므로, 근접성으로 인한 임의의 인력이 무시됩니다.
두 분자가 너무 멀지도 너무 가깝지도 않은 거리에서 서로 접근할 때, 그것들의 인력은 퍼텐셜 에너지의 크기가 증가함에 따라 증가하고 (더욱 음수가 됨), 총 내부 에너지가 낮아집니다.[20] 분자를 더 가깝게 만드는 인력은 물리적으로 더 가까이 이동하는 데 걸리는 시간 동안 분자가 근접해 있는 경우에만 발생할 수 있습니다. 따라서 인력은 분자가 낮은 속력으로 움직일 때 가장 강합니다. 이것은 기체 온도가 낮을 때 분자 사이의 인력이 중요하다는 것을 의미합니다. 어쨌든, 이 차가운 기체를 작은 부피로 등온적으로 압축하여, 분자를 근접하게 만들고, 압력을 높이면, 충돌이 발생하는 율이 크게 증가하므로 반발력이 인력을 지배하기 시작할 것입니다. 그러므로, 낮은 온도와 낮은 압력에서, 인력이 지배적인 분자-사이 상호 작용입니다.
만약 두 분자가 교차하지 않는 경로를 따라 임의적인 방향으로 높은 속력으로 이동하면, 그것들은 인력의 런던-분산력의 영향을 받을 만큼 근접한 시간을 충분히 보내지 않을 것입니다. 만약 두 분자가 충돌하면, 그것들은 너무 빨리 움직이고 그것들의 운동 에너지가 인력의 퍼텐셜 에너지보다 훨씬 커서 충돌 시에만 반발력을 경험하게 됩니다. 따라서, 분자 사이의 인력은 높은 속력으로 인해 높은 온도에서 무시될 수 있습니다. 높은 온도와 높은 압력에서, 반발력이 지배적인 분자-사이 상호 작용입니다.
실제 기체인 이들 인력과 반발력을 초래하는 위에 언급된 효과를 설명하면, 다음 일반화에 의해 이상적인 기체 모델에서 설명됩니다:[21]
- 낮은 온도와 낮은 압력에서, 실제 기체가 차지하는 부피는 이상적인 기체 법칙에 의해 예측된 부피보다 작습니다.
- 높은 온도와 높은 압력에서, 실제 기체가 차지하는 부피는 이상적인 기체 법칙에 의해 예측된 부피보다 큽니다.
Mathematical models
(기체에 대한) 상태 방정식은 기체의 상태 속성을 대략적으로 설명하거나 예측하기 위해 사용되는 수학적 모델입니다. 현재에서, 모든 조건에서 모든 기체의 속성을 정확하게 예측하는 단일 상태 방정식은 없습니다. 그러므로, 특정 온도와 압력 범위에서 기체에 대해 훨씬 더 정확한 상태 방정식이 많이 개발되어 왔습니다. 가장 널리 논의되는 "기체 모델"은 "완전한 기체", "이상적인 기체", 및 "실제 기체"입니다. 이들 각 모델은 주어진 열역학 시스템의 분석을 용이하게 하기 위한 고유한 가정의 집합을 가집니다.[22] 각각의 연속 모델은 그것이 적용되는 적용 범위의 온도 범위를 확장합니다.
Ideal and perfect gas
이상적인 기체 또는 완전한 기체의 상태 방정식(equation of state)은 이상적인 기체 법칙(ideal gas law)이고 다음과 같습니다:
여기서 P는 압력, V는 부피, n은 기체의 총양 (몰 단위), R은 보편적인 기체 상수(universal gas constant) 8.314 J/(mol K), 및 T는 온도입니다. 이런 식으로 작성하면, 그것이 분자 n의 수를 강조하기 때문에, 때때로 "화학자의 버전"이라고 불립니다. 그것은 역시 다음과 같이 쓸 수 있습니다:
여기서 는 특정 기체에 대한 지정 기체 상수 (단위 J/(kg K))이고, ρ = m/V는 밀도입니다. 이 표기법은 화학 반응 없이 가속을 포함하는 기체 흐름을 모델링하는 데 더 실용적인 "기체 역학자의" 버전입니다.
이상적인 기체 법칙은 기체의 비열에 대해 가정하지 않습니다. 가장 일반적인 경우에서, 비열은 온도와 압력의 함수입니다. 만약 특정 응용 분야에서 압력-의존성이 무시되면 (그리고 온도-의존성도 무시할 수 있음), 비록 정확한 가정은 저자 및/또는 과학 분야에 따라 다를 수 있지만 때때로 그 기체는 완전한 기체라고 말합니다.
이상적인 기체에 대해, 비열에 대한 제한 없이 이상적인 기체 법칙이 적용됩니다. 이상적인 기체는 압축가능성 인수 Z가 1로 설정되어 이 공압 비율이 일정하게 유지된다는 것을 의미하는 단순화된 "실제 기체"입니다. 압축가능성 인수가 1이면 이상적인 기체 법칙을 따르기 위해 4개의 상태 변수가 필요합니다.
실제 해결책이 있어야 하는 위치에 대한 "볼-파크(ball-park)" 범위를 생성하는 데 더 간단한 모델을 사용할 수 있지만, 이 근사는 공학 응용 프로그램에 더 적합합니다. "이상적인 기체 근사"가 적합한 예는 제트 엔진의 연소실 내부입니다.[23] 배출량 계산을 위해 기본 반응과 화학적 해리를 유지하는 것도 유용할 수 있습니다.
Real gas

아래 목록화된 각 가정 중 하나는 문제 해결의 복잡성을 더합니다. 기체의 밀도가 상승하는 압력과 함께 증가함에 따라, 분자-사이 힘은 이상적인 기체 법칙이 더 이상 "합리적인" 결과를 제공하지 않는 결과를 초래하는 기체 행동에서 더 중요한 역할을 합니다. 엔진 온도 범위의 위쪽 끝 (예를 들어, 연소기 섹션 – 1300K)에서, 복잡한 연료 입자는 회전과 진동을 통해 내부 에너지를 흡수하여 비열이 이원자 분자와 귀족 기체의 비열과 달라집니다. 해당 온도의 두 배 이상에서, 기체 입자의 전자 여기와 해리가 발생하기 시작하여 압력이 더 많은 입자 수에 맞게 조정됩니다 (가스에서 플라즈마로 전환).[24] 마지막으로, 모든 열역학 과정은 고정된 분포에 따라 속도가 달라지는 균등 기체를 설명하는 것으로 가정되었습니다. 비-평형 상황을 사용한다는 것은 해결을 가능하게 하기 위해 흐름 필드가 어떤 방식으로 특성화되어야 함을 의미합니다. 이상적인 기체 법칙의 경계를 확장하려는 첫 번째 시도 중 하나는 pVn = 상수를 읽도록 방정식을 조정하고 그런-다음 비열 비율(specific heat ratio) γ와 같은 다른 값을 통해 n을 변경함으로써 다양한 열역학적 과정에 대한 적용 범위를 포함하는 것이었습니다.
실제 기체 효과에는 기체 동작의 더 넓은 범위를 설명하기 위해 수행된 조정이 포함됩니다:
- 압축가능성 효과(Compressibility effects) (Z는 1.0에서 다양하게 허용됨)
- 변하는 열 용량(heat capacity) (비열은 온도에 따라 다름)
- 반 데르 발스 힘 (압축가능성과 관련됨, 다른 상태 방정식으로 대체할 수 있음)
- 비-평형 열역학 효과(Non-equilibrium thermodynamic effects)
- 변하는 합성을 갖는 분자 해리(dissociation)와 기본 반응(elementary reactions) 문제.
대부분의 응용에서, 그러한 상세한 분석은 과도합니다. 실제 기체 효과가 상당한 영향을 미칠 수 있는 예는 극도로 높은 온도와 압력이 존재하는 우주 왕복선 재진입 또는 1990년 Redoubt 산의 폭발 이미지에서와 같이 지질학적 사건 중에 생성된 기체에 있습니다.
Permanent gas
영구 기체는 정상적인 인간 거주 온도 범위보다 낮은 임계 온도를 가지고 있어 이 범위 내의 압력에 의해 액화될 수 없는 기체에 사용되는 용어입니다. 역사적으로, 그러한 기체는 액화하는 것이 불가능한 것으로 생각되어 영구적으로 기체 상태로 남아있을 것입니다. 그 용어는 주변 온도 저장과 높은 압력에서의 기체 수송과 관련이 있습니다.[25]
Historical research
Boyle's law

보일의 법칙은 아마도 상태 방정식의 첫 번째 표현일 것입니다. 1662년 로버트 보일(Robert Boyle)은 한쪽 끝이 밀봉된 J자형 유리 튜브를 사용하여 일련의 실험을 수행했습니다. 튜브에 수은을 첨가하여, 튜브의 짧고 밀봉된 끝에 고정된 양의 공기를 가두었습니다. 그런-다음 추가 수은이 튜브에 추가됨에 따라 기체의 부피를 주의 깊게 측정했습니다. 기체의 압력은 튜브의 짧은 쪽 끝과 길고 열린 쪽 끝의 수은 수준의 차이에 의해 결정될 수 있습니다. 보일의 장비 이미지는 보일이 기체를 연구하는 동안 사용한 이국적인 도구 중 일부를 보여줍니다.
이들 실험을 통해, 보일은 일정한 온도를 유지하는 기체에 가해지는 압력이 기체의 부피와 반비례한다는 사실에 주목했습니다.[26] 예를 들어, 부피가 반으로 줄어들면, 압력은 두 배가 됩니다; 그리고 부피가 두 배가 되면, 압력은 반으로 줄어듭니다. 압력과 부피 사이의 역 관계가 주어지면, 압력 (P)과 부피 (V)의 곱은 온도가 일정한 한 제한된 기체의 주어진 질량에 대해 상수 (k)입니다. 공식으로 나타내면 다음과 같습니다:
전후 온도가 같은 고정된 양의 기체의 전후 부피와 압력은 둘 다 상수 k와 같기 때문에, 그것들은 다음 방정식으로 관련될 수 있습니다:
Charles's law
1787년 프랑스의 물리학자이자 풍선 선구자, Jacques Charles는 산소, 질소, 수소, 이산화탄소, 및 공기가 같은 80 켈빈 구간에서 같은 정도로 팽창한다는 사실을 발견했습니다. 그는 일정한 압력에서 이상적인 기체에 대해 부피가 온도에 정비례한다는 점에 주목했습니다:
Gay-Lussac's law
1802년에, Joseph Louis Gay-Lussac은 유사하지만, 더 광범위한 실험을 통한 결과를 발표했습니다.[27] Gay-Lussac은 Charles를 기리기 위해 그 법칙을 이름-지음으로써 Charles의 초기 연구를 인정했습니다. Gay-Lussac 자신이 1809년에 발견한 압력을 설명하는 법칙을 만든 것으로 알려져 있습니다. 그것은 이상적인 기체가 용기 측면에 가하는 압력은 온도에 비례한다는 것입니다.
Avogadro's law
1811년에, 아메데오 아보가드로(Amedeo Avogadro)는 같은 부피의 순수한 기체는 같은 수의 입자를 포함하고 있음을 확인했습니다. 그의 이론은 또 다른 이탈리아 화학자 Stanislao Cannizzaro가 비-이상적인 예외를 설명할 수 있었던 1858년까지 일반적으로 받아들여지지 않았습니다. 100년 전 기체에 대한 그의 연구에서, 그의 이름이 붙은 물리적 상수 (아보가드로 상수)는 원소 탄소-12의 몰당 원자 수 (6.022×1023 mol−1)입니다. 표준 온도와 압력 (이상적인 기체 법칙)에서 이 특정 수의 기체 입자는 몰 부피(molar volume)라고 참조되는 22.40 리터를 차지합니다.
아보가드로의 법칙에 따르면 이상적인 기체가 차지하는 부피는 부피에 포함된 물질의 총량에 비례합니다. 이것은 STP에서 22.4 dm3/mol (몰당 리터)인 기체의 몰 부피를 발생시킵니다. 그 관계는 다음과 같이 주어집니다:여기서 n은 기체 물질의 총량 (분자 수를 아보가드로 상수로 나눈 값)입니다.
Dalton's law

1801년에, John Dalton은 이상적인 기체 법칙 관계에 대한 연구에서 부분 압력의 법칙을 발표했습니다: 비 반응성 기체 혼합물의 압력은 모든 구성 기체의 압력의 합과 같습니다. 수학적으로, 이것은 n 종에 대해 다음과 같이 나타낼 수 있습니다:
- Pressuretotal = Pressure1 + Pressure2 + ... + Pressuren
Dalton의 일지 이미지는 그가 따랐던 경로를 기록하기 위해 속기로 사용한 상징을 묘사합니다. 비-반응성 "탄성 유체" (기체) 혼합에 대한 그의 주요 일지 관찰 내용은 다음과 같습니다:[28]
- 액체와 달리, 무거운 기체는 혼합 시 바닥으로 흘러내리지 않습니다.
- 기체 입자의 정체는 최종 압력을 결정하는 데 아무런 역할을 하지 않았습니다 (그것들은 마치 크기가 무시할 수 있는 것처럼 행동했습니다).
Special topics
Compressibility

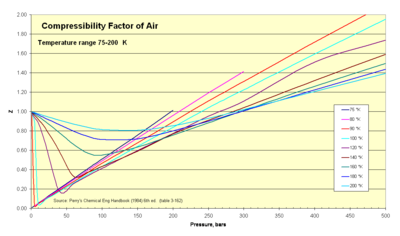
열역학자들은 이 계수 (Z)를 사용하여 실제 기체의 압축가능성 효과를 설명하기 위해 이상적인 기체 방정식을 변경합니다. 이 계수는 실제 대 이상적인 비-부피의 비율을 나타냅니다. 그것은 때때로 설계 목적을 위해 이상적인 기체 법칙의 유용한 범위를 확장하기 위한 수정 또는 "fudge-factor"라고도 참조됩니다. 보통 이 Z 값은 단일성에 매우 가깝습니다. 압축가능성 계수 이미지는 매우 낮은 온도 범위에서 Z가 어떻게 변하는지 보여줍니다.
Reynolds number
유체 역학에서, 레이놀즈 숫자는 관성력 (vsρ) 대 점성력 (μ/L)의 비율입니다. 그것은 유체 역학에서 가장 중요한 무차원 숫자 중 하나이고 보통 다른 무차원 수와 함께 동적 유사성을 결정하는 데 기준을 제공하기 위해 사용됩니다. 이를테면, 레이놀즈 숫자는 모델링 결과 (설계)와 전체 규모 실제 조건 사이의 연결 고리를 제공합니다. 그것은 흐름을 특성화하는 데 사용할 수도 있습니다.
Viscosity

물리적 속성, 점도는 인접한 분자가 서로 얼마나 잘 달라붙는지에 대한 측정입니다. 고체는 이들 점착성 분자-사이 힘의 강도로 인해 전단력을 견딜 수 있습니다. 유체는 비슷한 하중을 받으면 연속적으로 변형됩니다. 기체는 액체보다 낮은 점도의 값을 가지지만, 여전히 관찰 가능한 속성입니다. 만약 기체가 점도를 가지지 않으면, 그것들은 날개 표면에 달라붙지 않고 경계 층을 형성하지 않습니다. Schlieren 이미지에서 델타 날개(delta wing)에 대한 연구는 기체 입자가 서로 달라붙는다는 것을 보여줍니다 (경계 층 섹션을 참조).
Turbulence

유체 역학에서, 난기류 또는 휘몰아치는 흐름은 혼돈의 확률적 속성 변화를 특징으로 하는 흐름 영역입니다. 여기에는 낮은 운동량 확산, 높은 운동량 대류, 및 시간과 공간에서 압력과 속도의 급격한 변화가 포함됩니다. Robinson Crusoe Islands 주변 날씨의 위성 보기는 한 가지 예를 보여줍니다.
Boundary layer
실제로 입자는 통과하는 물체의 표면에 "고착"됩니다. 이 입자 층을 경계 층이라고 불립니다. 물체의 표면에서, 표면의 마찰로 인해 본질적으로 정적입니다. 경계 층을 갖는 대상은 사실상 대상이 접근할 때 나머지 분자가 "보는" 대상의 새로운 모양입니다. 이 경계 층은 표면에서 분리되어 본질적으로 새로운 표면을 생성하고 흐름 경로를 완전히 변경합니다. 이에 대한 고전적인 예제는 실속 익형(stalling airfoil)입니다. 델타 날개 이미지는 기체가 앞쪽 가장자리를 따라 오른쪽에서 왼쪽으로 흐를 때 경계 층이 두꺼워지는 것을 명확하게 보여줍니다.
Maximum entropy principle
자유도의 총 숫자가 무한대에 가까워짐에 따라, 시스템은 가장 높은 중복도(multiplicity)에 해당하는 거시적 상태에서 발견됩니다. 이 원리를 설명하기 위해, 얼어붙은 금속 막대의 피부 온도를 관찰하십시오. 피부 온도의 열 이미지를 사용하여, 표면 위의 온도 분포를 기록합니다. 이 초기 온도 관찰은 "마이크로-상태"를 나타냅니다. 미래 시점에서, 피부 온도를 두 번째로 관찰하면 두 번째 마이크로-상태가 생성됩니다. 이 관찰 과정을 계속함으로써, 막대 표면의 열 이력을 설명하는 일련의 마이크로-상태를 생성할 수 있습니다. 이 역사적인 일련의 마이크로-상태의 특성화는 모든 마이크로-상태를 단일 그룹으로 성공적으로 분류하는 매크로-상태를 선택함으로써 가능합니다.
Thermodynamic equilibrium
시스템에서 에너지 전달이 중단될 때, 이 상태는 열역학적 평형이라고 참조됩니다. 보통, 이 조건은 시스템과 주변 환경이 열이 그들 사이에서 더 이상 전달되지 않도록 같은 온도에 있음을 의미합니다. 그것은 역시 외력이 균형을 이루고 (부피가 변하지 않음), 시스템 내의 모든 화학 반응이 완료됨을 의미합니다. 이들 사건에 대해 타임라인은 해당 시스템에 따라 다릅니다. 실온에서 얼음 용기를 녹이는 데는 몇 시간이 걸리지만, 반도체에서는 장치가 켜진 상태에서 꺼진 상태로 전환될 때 발생하는 열 전달이 몇 나노초 정도일 수 있습니다.
To From
|
Solid | Liquid | Gas | Plasma |
|---|---|---|---|---|
| Solid | Melting | Sublimation | ||
| Liquid | Freezing | Vaporization | ||
| Gas | Deposition | Condensation | Ionization | |
| Plasma | Recombination |
See also
Notes
- ^ "Gas". Merriam-Webster.
{{cite web}}: CS1 maint: url-status (link) - ^ This early 20th century discussion infers what is regarded as the plasma state. See page 137 of American Chemical Society, Faraday Society, Chemical Society (Great Britain) The Journal of Physical Chemistry, Volume 11 Cornell (1907).
- ^ "Quantum Gas Microscope Offers Glimpse Of Quirky Ultracold Atoms". ScienceDaily. Retrieved 2023-02-06.
- ^ Zelevinsky, Tanya (2009-11-09). "—just right for forming a Bose-Einstein condensate". Physics. 2 (20): 94. arXiv:0910.0634. doi:10.1103/PhysRevLett.103.200401. PMID 20365964. S2CID 14321276.
- ^ Helmont, Jan Baptist Van (1652). Ortus medicinae, id est initia physicae inaudita... authore Joanne Baptista Van Helmont,... (in Latin). apud L. Elzevirium.
- ^ Ley, Willy (June 1966). "The Re-Designed Solar System". For Your Information. Galaxy Science Fiction. pp. 94–106.
- ^ Harper, Douglas. "gas". Online Etymology Dictionary.
- ^ Draper, John William (1861). A textbook on chemistry. New York: Harper and Sons. p. 178.
- ^ ""gas, n.1 and adj."". OED Online. Oxford University Press. June 2021.
There is probably no foundation in the idea (found from the 18th cent. onwards, e.g. in J. Priestley On Air (1774) Introd. 3) that van Helmont modelled gas on Dutch geest spirit, or any of its cognates
- ^ Barzun, Jacques (2000). For Dawn to Decadence: 500 Years of Western Cultural Life. New York: HarperCollins Publishers. p. 199.
- ^ The authors make the connection between molecular forces of metals and their corresponding physical properties. By extension, this concept would apply to gases as well, though not universally. Cornell (1907) pp. 164–5.
- ^ One noticeable exception to this physical property connection is conductivity which varies depending on the state of matter (ionic compounds in water) as described by Michael Faraday in 1833 when he noted that ice does not conduct a current. See page 45 of John Tyndall's Faraday as a Discoverer (1868).
- ^ John S. Hutchinson (2008). Concept Development Studies in Chemistry. p. 67.
- ^ Anderson, p.501
- ^ J. Clerk Maxwell (1904). Theory of Heat. Mineola: Dover Publications. pp. 319–20. ISBN 978-0-486-41735-6.
- ^ See pages 137–8 of Society, Cornell (1907).
- ^ Kenneth Wark (1977). Thermodynamics (3 ed.). McGraw-Hill. p. 12. ISBN 978-0-07-068280-1.
- ^ For assumptions of kinetic theory see McPherson, pp.60–61
- ^ Jeschke, Gunnar (26 November 2020). "Canonical Ensemble". Archived from the original on 2021-05-20.
- ^ "Lennard-Jones Potential - Chemistry LibreTexts". 2020-08-22. Archived from the original on 2020-08-22. Retrieved 2021-05-20.
- ^ "14.11: Real and Ideal Gases - Chemistry LibreTexts". 2021-02-06. Archived from the original on 2021-02-06. Retrieved 2021-05-20.
- ^ Anderson, pp. 289–291
- ^ John, p.205
- ^ John, pp. 247–56
- ^ "Permanent gas". www.oxfordreference.com. Oxford University Press. Retrieved 3 April 2021.
- ^ McPherson, pp.52–55
- ^ McPherson, pp.55–60
- ^ John P. Millington (1906). John Dalton. pp. 72, 77–78.
References
- Anderson, John D. (1984). Fundamentals of Aerodynamics. McGraw-Hill Higher Education. ISBN 978-0-07-001656-9.
- John, James (1984). Gas Dynamics. Allyn and Bacon. ISBN 978-0-205-08014-4.
- McPherson, William; Henderson, William (1917). An Elementary study of chemistry.
Further reading
- Philip Hill and Carl Peterson. Mechanics and Thermodynamics of Propulsion: Second Edition Addison-Wesley, 1992. ISBN 0-201-14659-2
- National Aeronautics and Space Administration (NASA). Animated Gas Lab. Accessed February 2008.
- Georgia State University. HyperPhysics. Accessed February 2008.
- Antony Lewis WordWeb. Accessed February 2008.
- Northwestern Michigan College The Gaseous State. Accessed February 2008.
- Lewes, Vivian Byam; Lunge, Georg (1911). . Encyclopædia Britannica. Vol. 11 (11th ed.). p. 481–493.









